文章來源:醫(yī)療器械創(chuàng)新網(wǎng)
7月30日,上海發(fā)布了《關(guān)于支持生物醫(yī)藥產(chǎn)業(yè)全鏈條創(chuàng)新發(fā)展的若干意見》(下稱《意見》),其中強(qiáng)調(diào)對創(chuàng)新醫(yī)療器械開發(fā)加大支持力度,鼓勵企業(yè)開展原始創(chuàng)新,大力培育重磅產(chǎn)品。包括加快第二類醫(yī)療器械注冊審評,加快創(chuàng)新產(chǎn)品應(yīng)用推廣,鼓勵創(chuàng)新產(chǎn)品入院配備使用,加大創(chuàng)新產(chǎn)品醫(yī)保支付支持力度,加大創(chuàng)新產(chǎn)品全球注冊認(rèn)證支持力度。該《意見》將于2024年8月1日實(shí)施,有效期至2029年7月31日,為期5年。
《意見》中提到,持續(xù)加大創(chuàng)新醫(yī)療器械開發(fā)支持力度,對進(jìn)入國家和上海市創(chuàng)新醫(yī)療器械特別審查程序的產(chǎn)品,按照規(guī)定給予最高300萬元支持;以上產(chǎn)品首次取得注冊證并落地生產(chǎn)的,按照規(guī)定再給予不超過研發(fā)投入的40%,最高800萬元支持。每個單位每年累計(jì)支持金額最高3000萬元。
《意見》圍繞研發(fā)、臨床、審評審批、應(yīng)用推廣、產(chǎn)業(yè)化落地、投融資、數(shù)據(jù)資源、國際化等關(guān)鍵環(huán)節(jié),堅(jiān)持全鏈條創(chuàng)新、全鏈條改革、全鏈條賦能,推出了8方面37條政策舉措。重點(diǎn)支持以下六個方面:
加大對創(chuàng)新藥械研發(fā)的支持,鼓勵企業(yè)開展原始創(chuàng)新,大力培育重磅產(chǎn)品。前瞻布局基因與細(xì)胞治療、合成生物、再生醫(yī)學(xué)、醫(yī)療機(jī)器人、高端醫(yī)療影像等前沿賽道。對進(jìn)入國家和上海市創(chuàng)新醫(yī)療器械特別審查程序的產(chǎn)品,以及首次取得注冊證并落地生產(chǎn)的,按照規(guī)定分別給予一定研發(fā)投入支持。
持續(xù)增設(shè)研究型床位,建設(shè)功能完備、集約共享的研究型病房。完善臨床成果作價(jià)入股等轉(zhuǎn)化機(jī)制,優(yōu)化成果評價(jià)和團(tuán)隊(duì)激勵機(jī)制。引導(dǎo)保險(xiǎn)機(jī)構(gòu)加強(qiáng)對臨床試驗(yàn)和產(chǎn)品創(chuàng)新的風(fēng)險(xiǎn)補(bǔ)償,完善風(fēng)險(xiǎn)共擔(dān)機(jī)制。
進(jìn)一步縮短產(chǎn)品研發(fā)和上市周期
通過建立臨床預(yù)備隊(duì)列等創(chuàng)新舉措,力爭將臨床啟動時(shí)間壓縮到25周內(nèi)。建立倫理審查“一套材料、一次提交”等機(jī)制,將總體流程壓縮至3周內(nèi)。加快第二類醫(yī)療器械審評,將審評平均時(shí)限壓縮至40個工作日以內(nèi)。
進(jìn)一步加快創(chuàng)新藥械應(yīng)用推廣
推動更多“新優(yōu)藥械”入院、入醫(yī)保,確保上海市醫(yī)療機(jī)構(gòu)將相應(yīng)創(chuàng)新藥械“應(yīng)配盡配”。加大創(chuàng)新產(chǎn)品醫(yī)保支付力度,對相關(guān)診療項(xiàng)目實(shí)行醫(yī)保預(yù)算單列支付、在DRG/DIP即疾病診斷相關(guān)分組/病種分值改革中單獨(dú)支付。大力支持上海市創(chuàng)新藥械國際化發(fā)展。
強(qiáng)化投融資支持,發(fā)揮生物醫(yī)藥產(chǎn)業(yè)母基金、股權(quán)投資基金、創(chuàng)新轉(zhuǎn)化基金等作用,加強(qiáng)戰(zhàn)略紓困投資。鼓勵政府引導(dǎo)基金“投早投小硬科技”。鼓勵企業(yè)風(fēng)險(xiǎn)投資,設(shè)立產(chǎn)業(yè)并購基金,支持企業(yè)并購重組、做大做強(qiáng)。釋放數(shù)據(jù)要素價(jià)值,推動隊(duì)列研究數(shù)據(jù)開放共享,打造高質(zhì)量語料庫和行業(yè)數(shù)據(jù)集,推動行業(yè)數(shù)據(jù)依法合規(guī)交易、跨境安全流動。推出500萬方標(biāo)準(zhǔn)化廠房,保障重大產(chǎn)業(yè)項(xiàng)目加快落地。
提升制度型開放水平,支持在上海自貿(mào)試驗(yàn)區(qū)(含臨港新片區(qū))符合條件的外資企業(yè)開展基因診斷與治療技術(shù)開發(fā)和應(yīng)用。優(yōu)化研發(fā)用物品進(jìn)口試點(diǎn)政策,支持細(xì)胞治療產(chǎn)品及相關(guān)特殊物品進(jìn)出境。充分發(fā)揮市區(qū)聯(lián)動專班機(jī)制、“4個100”清單制度等作用,強(qiáng)化為企服務(wù),持續(xù)打造一流營商環(huán)境。生物醫(yī)藥,上海三大先導(dǎo)產(chǎn)業(yè)之一
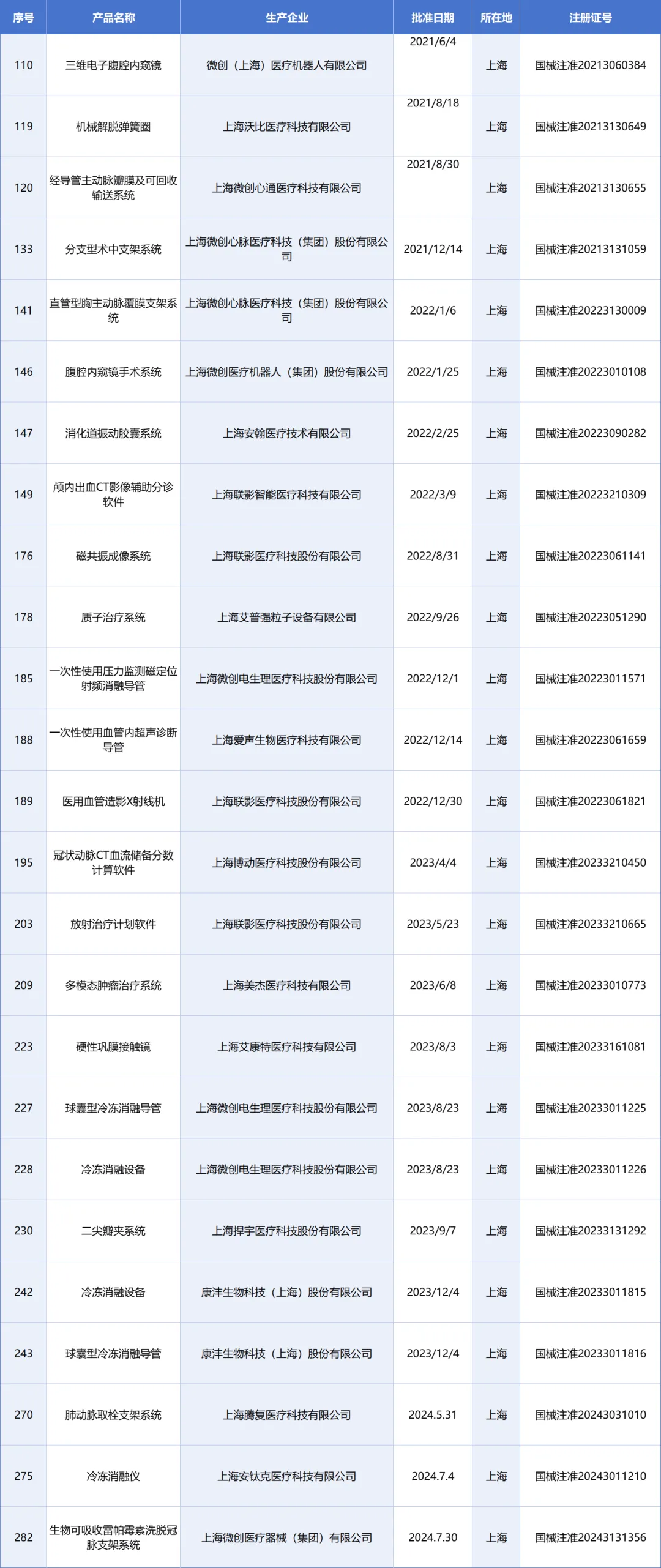
生物醫(yī)藥是上海市重點(diǎn)發(fā)展的三大先導(dǎo)產(chǎn)業(yè)之一,也是加快培育發(fā)展新質(zhì)生產(chǎn)力的重要領(lǐng)域。近年來,上海市全力打造具有全球影響力的生物醫(yī)藥產(chǎn)業(yè)創(chuàng)新高地,推出了一系列政策舉措,取得了積極的成效。2021年,上海市發(fā)布了促進(jìn)生物醫(yī)藥產(chǎn)業(yè)發(fā)展的若干意見。該意見實(shí)施以來,創(chuàng)新成果不斷涌現(xiàn),已有19款1類創(chuàng)新藥和26款三類創(chuàng)新醫(yī)療器械獲批上市,“首發(fā)引領(lǐng)”特征進(jìn)一步凸顯,在腫瘤、代謝、免疫、神經(jīng)等領(lǐng)域,涌現(xiàn)出了一批全球首研新藥、全國首發(fā)細(xì)胞治療新藥和國際一流醫(yī)療器械。產(chǎn)業(yè)能級加快躍升,2021年至2023年,生物醫(yī)藥產(chǎn)業(yè)規(guī)模從7617億元提升至9337億元,制造業(yè)產(chǎn)值由1712億元增長到1860億元;今年上半年,制造業(yè)產(chǎn)值達(dá)到935億元,較去年同期增加了37億元。與此同時(shí),細(xì)胞與基因治療、合成生物學(xué)、醫(yī)療機(jī)器人、高端醫(yī)療影像等前沿新賽道,正在加快孕育發(fā)展新動能。
有業(yè)內(nèi)專業(yè)人士表示,此次上海出臺的政策力度極大,看得出上海在推進(jìn)創(chuàng)新醫(yī)療領(lǐng)域的發(fā)展決心,有望讓上海在現(xiàn)有基礎(chǔ)上進(jìn)一步取得行業(yè)領(lǐng)域地位。
26款創(chuàng)新醫(yī)療器械獲批上市
鼓勵醫(yī)療器械創(chuàng)新,誰將受益?
《意見》強(qiáng)調(diào)了大力發(fā)展生物醫(yī)藥全產(chǎn)業(yè)鏈,覆蓋整個研發(fā)、生產(chǎn)、注冊、推廣全生命周期,在上海已經(jīng)聚集了一批頭部醫(yī)療器械及醫(yī)藥頭部企業(yè)落戶,這一政策將進(jìn)一步利好本土創(chuàng)新醫(yī)療器械公司及跨國企業(yè)。
通過上圖不難看出,以微創(chuàng)系為代表有10余款創(chuàng)新醫(yī)療器械獲批上市,包括上海聯(lián)影醫(yī)療、上海艾普強(qiáng)等10余家企業(yè)或?qū)⑹芤妗?/span>
此外,《意見》旨在解決醫(yī)械創(chuàng)新鏈條中存在的障礙和難點(diǎn),目前創(chuàng)新產(chǎn)品進(jìn)入醫(yī)院仍然面臨較大挑戰(zhàn),尤其是臨床試驗(yàn)的等待時(shí)間較長。為了改善這一狀況,新政策提出將第二類醫(yī)療器械的注冊審評平均時(shí)間縮短至40個工作日之內(nèi)。此外,對于那些具有明確臨床價(jià)值且創(chuàng)新性突出的第二類醫(yī)療器械,政策鼓勵申請?zhí)貏e審查程序,并給予優(yōu)先處理,包括注冊檢驗(yàn)、技術(shù)審評以及注冊體系核查等方面的支持。這些措施清晰地表明了政府在推動醫(yī)療器械創(chuàng)新發(fā)展方面的堅(jiān)定決心。
除了上海,針對提升我國醫(yī)療器械創(chuàng)新研發(fā),國家及各省市部門均出臺了相關(guān)扶持政策。
丨 北京市醫(yī)保局等九部門聯(lián)合發(fā)布了《北京市支持創(chuàng)新醫(yī)藥高質(zhì)量發(fā)展若干措施(2024年)》。對符合條件的創(chuàng)新醫(yī)療器械實(shí)施單獨(dú)支付政策,即這些費(fèi)用不會計(jì)入DRG(疾病診斷相關(guān)分組)支付標(biāo)準(zhǔn)之中,《中關(guān)村創(chuàng)新醫(yī)療器械產(chǎn)品目錄》會定期更新。
丨國家層面,創(chuàng)新醫(yī)療器械在某些情況下可以豁免DRG支付模式,這意味著其費(fèi)用將不計(jì)入常規(guī)的按疾病診斷分組的支付標(biāo)準(zhǔn)中。
丨2018年發(fā)布的《創(chuàng)新醫(yī)療器械特別審查程序》為具有中國發(fā)明專利且技術(shù)上有重大改進(jìn)或填補(bǔ)國內(nèi)空白的產(chǎn)品提供了特別通道。此外國家醫(yī)保局多次表示將充分考慮給予創(chuàng)新醫(yī)療器械應(yīng)用的支持。
這些政策表明我國國家乃至地方政府都正積極推動醫(yī)療器械行業(yè)的創(chuàng)新發(fā)展,特別是在鼓勵本土創(chuàng)新和提高國產(chǎn)醫(yī)療器械市場競爭力方面。相信在一些列政策扶持下,將為我國創(chuàng)新醫(yī)療器械領(lǐng)域走向快速發(fā)展階段。
▲文章來源:醫(yī)療器械創(chuàng)新網(wǎng)
 官方微信
官方微信